*Reviewed:从单标记到多标记的免疫荧光技术*
*Abstract*
免疫荧光标记技术是借助免疫学抗原与抗体特异性结合的原理,通过蛋白荧光标记的手段,使得蛋白质可见光化,以研究目标特定蛋白(抗原/抗体)的表达定量和形态定位的技术手段,是在制片过程中使用的一种标记技术,在不断的发展中,形成了从单标记到多标记的技术突破,这些突破使得免疫荧光技术能够研究不同蛋白间的相互作用、共表达、共定位,研究信号通路上下游蛋白表达的关系。
免疫荧光标记技术广泛运用于病毒、细菌检测,组织病理学诊断,具有较好的可行性,当然也存在一些不足的地方,针对不足之处,发展出了不同的技术来完善和补充,本报告主要从技术的设备、标记原理方法及其运用等方面来概括免疫荧光技术的发展和实际运用。
*免疫荧光技术的设备基础*
在免疫荧光技术中,需要运用到免疫荧光试剂(染料),特定蛋白抗体(抗体一&抗体二),在制片过程中需要恒温冰冻切片机、自动脱水机、石蜡切片机等设备,在观察切片效果时,运用的显微镜可为激光扫描共聚焦显微镜(光谱分析技术)、荧光显微镜、透射电镜显微镜。在光谱成像检测之外,也有使用质谱技术检测切片荧光标记结果的例子。
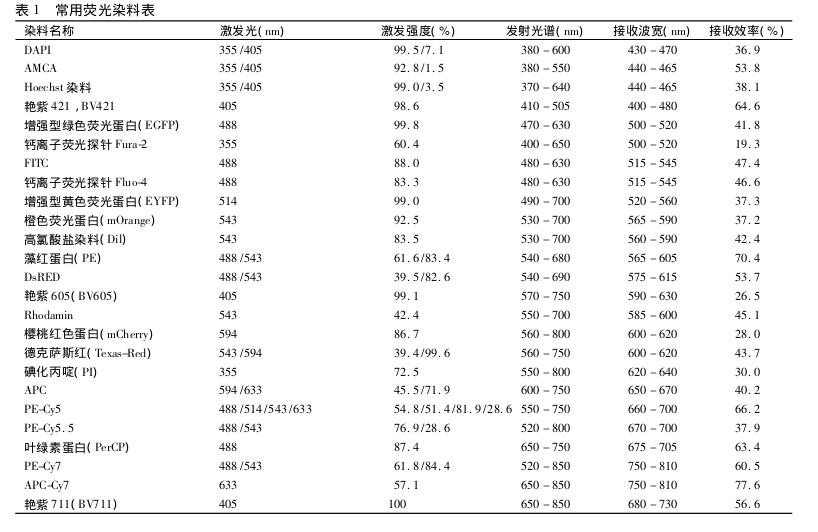
免疫荧光试剂染料种类繁多,包括有机小分子染料、 半导体量子点、 稀土离子配合物,其中有机小分子染料多为含有多环芳烃的有机分子,是目前应用最为普遍的荧光素。·[1]
*Method*
在免疫荧光技术的发展上,主要是围绕着荧光信号增强、多标记分辨的思路和实际需要进行发展的。
传统单标记及其向多标记发展的局限
传统上,单蛋白标记单纯使用抗原-抗体-荧光蛋白的思路,使用单一抗体标记后发现观察到的实验结果荧光信号弱,于是引入第二抗体,形成了抗原-抗体×2-荧光蛋白的复合体,使得荧光信号增强,但是第二抗体由于抗体种属的限制使得其选择性少,从而难以找到标记第二种蛋白质的抗体。为了克服这一问题,发展出了循环洗脱复染(simple)技术,即进行单标记观测得到图像,然后洗脱染料和抗体,反复多次,将所有图像通过 image j 图像叠加原理叠加,从而使得多种蛋白在同一图片中共显示。类似的方法是连续切片法,这些都一定程度上间接达到了多标记的目地,但由于洗脱等操作造成的破坏和损失,对实验的精确度有一定的影响。
在向多标记发展的过程中,另外一个要避免的是多标记多种染料颜色之间的干扰和重叠,同时切片自发荧光背景干扰也是一个令人头痛的问题,这些都直接关系到检测的结果和精确度,当然也是一个可以设计解决的问题。
在这些问题面前,选择了不同的突破口会有不同的技术进展,站在风口浪尖上着眼于突破抗体种属的限制或者改良simple技术都给免疫荧光标记技术带来了不同的发展,但是其突破口都集中体现在染色过程中抗体淬灭的处理上。
突破抗体种属问题的opal技术
在传统方法的一抗、二抗孵育之后,利用opal技术进行TSA信号放大,基于TSA信号增强原理的opal技术,利用HRP(辣根过氧化氢酶)作用下,荧光标记酪胺(T)成激活态(T*)之后,T× 与蛋白质上的酪氨酸残基成共价作用,而抗原抗体特异性结合属于非共价结合,作用力较小的缘故,从而利用微波加热的方式解离抗体A,从而使得抗体A能够用于下一轮的标记上,经过如此多轮反复染色循环,从而使得标记多种蛋白质在同一组织内得以实现。[3]
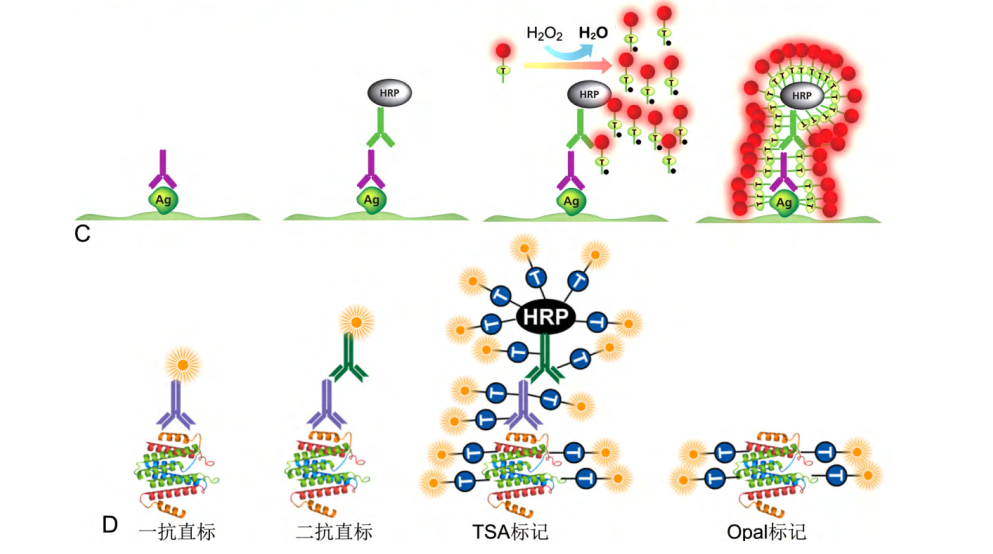
C,TSA 染色过程;D,TSA/Opal 与传统免疫染色标记方法的比较[3]
改良simple技术的多重间接免疫荧光细胞学染色技术
改良于simple技术的多重间接免疫荧光细胞学染色技术 ( 第一轮免疫荧光染色 - IgG Fab封闭法联合化学试剂清除法 - 第二轮免疫荧光染色 ),沿用后期图片处理时图片叠加的操作,发展出了更加有效的抗体淬灭和染料清除技术,减小了洗脱过程中的损伤等误差,在这个过程中,运用IgG Fab封闭未结合的抗体二(PH4-9)并观察成像,然后运用B-ME&SDS清除IgG,利用GnHcl清除IgM(用尿素中和该试剂),利用NaBH4清除染料,在洗脱过后循环反复,得到下一种蛋白质的荧光染色。[1]
*运用*
传统单标记在细菌、病毒检测中的运用
单标记可用于葡萄球菌、沙门氏菌、李斯特菌的检测与鉴别上,对于病毒的检测也具有很好的灵敏度,在寄生虫病的检测上也得到了广泛的运用。在抗原定位、病原微生物分布规律和亲嗜性、功能蛋白研究中也得到广泛运用。[5]
多标记技术的发展与在组织病理诊断上的作用
多标记技术更多地运用于肿瘤抗原以及微环境的检测,在心脏活检以及肾穿刺活检等组织病理学检测上也发挥着重要的作用。[2]
纳米金-银加强法与免疫荧光标记技术在神经科学上的运用
在2013年的一篇研究论文中, 来自徐州医学院的研究团队,利用opal技术和免疫金-银法标记观察了观察脑室管膜下区 (SVZ ) 神 经 干 细 胞 上 N- 甲 基 -D- 天 冬 氨 酸 受 体 亚 单 位 1(NR1)与行巢蛋白的超微分布,并认为“包 埋 前 免 疫 电 镜 双 重 标 记 技 术 对 组 织的抗原性保存较好, 免疫金颗粒对抗原定位 较 精 确, 有 利 于 研 究 两 种 递 质 在 同 一 个 细 胞 或 终 末 内 的共存或分析递质与其相应受体之间的联系, 特别是对于中枢神经系统的研究有独到之处。”[7]
其操作时首先使用opal技术对行巢蛋白进行标记,然后使用一抗、金标记的二抗依次对NR1进行标记,固定切片,进行银加强,后进行常规电镜制样。
该团队在实验后讨论中对实验操作提出了以下几点注意事项:“1 ) 固 定 剂 选 择 4%多聚甲醛 -1 戊 二 醛 -1% 饱 和 苦 味 酸, 这 样 既 考 虑到了固定液在组织 中 渗 透 速 度 要 快, 也 顾 及 到 组 织不能固定 过 久 而 影 响 抗 原 的 保 存;2 ) 选 用 厚 度 为150 μ m 的 脑 片 , 可 有 效 预 防 脱 水 时 切 片 卷 曲 3 ) 免 疫 染 色 后 在 体 视 显 微 镜 下 先 定 位 取 SVZ 效果较 理 想;5 ) 样 本 固 定 后 以 及 银 加 强前后, 脑片要充分漂洗干净, 避免样本内自由醛基与抗体结合以及杂质引起的非特异性;6 ) 由于抗体 很难穿透到组织深层, 修块时手又很难控制厚度, 所以包埋好的样品表面最好进行半薄修块;7 ) 超薄切片不经铀、 铅染色, 以防染色过程中可能出现的污染与金颗粒混淆。”[7]
*Disscussion*
免疫荧光技术为特定蛋白的检测和研究提供了一个比较准确和灵敏的方法,在一些比较研究中显示荧光探针pcr技术灵敏度与特异性高于免疫荧光技术,结果表明,免疫荧光技术受到试剂敏感性、特异性、染色时间、染色温度、以及抗体稀释度的影响。[6]同时切片也对观察结果带来一定影响,如果切片太薄 则会使得阳性表达减弱,如太厚则会出现假阳性的可能。
在对细胞染色的过程中,由于细胞骨架蛋白的表达稳定,容易与同源二抗重叠,所以一般的染色顺序为细胞膜蛋白到细胞骨架蛋白。在多荧光染色上,共染串色的可能性会随着染料的增多而增大,多色荧光染色方案的选择为5种或6种最可靠。[1]
现在免疫荧光技术的主要的研究方向主要是电脑光谱分析和图像处理上面,同时也通过电脑分析减少了一些误差和判断上的增强。[3]
*Reference*
[1]杨敏,田志华,马博,贾凯英,张鸿丽,富晶,綦雯雯,赵威.多重间接免疫荧光技术的建立及其在肝癌样本多种抗原检测中的应用[J].细胞与分子免疫学杂志,2018,34(02):97-104.
[2]胡斌.肾穿刺组织免疫荧光病理检查技术的应用研究[J].人人健康,2017(20):9.
[3]钱帮国,焦磊.多标记免疫荧光染色及多光谱成像技术在组织学研究中的应用[J].中国组织化学与细胞化学杂志,2017,26(04):373-382.
[4]王思思.免疫检测技术及其研究进展[J].临床医药文献电子杂志,2017,4(45):8905.
[5]杨旭清,张韬.免疫荧光技术在寄生虫病诊断中的应用[J].云南畜牧兽医,2016(06):40-41.
[6]俞松山,叶惠英,韩珊珊.免疫荧光技术与荧光探针PCR技术用于检测小儿呼吸道合胞病毒的对比分析[J].实用预防医学,2016,23(06):750-752.
[7]于红丽,李志宁,董富兴,张伟,董红燕.大鼠脑室管膜下区包埋前免疫电镜双标技术的探索[J].江苏医药,2013,39(14):1627-1629.
